10 de enero de 2022
Queridos amigos:
Después de soportar décadas de síntomas que abarcaron toda la gama, desde la pérdida de dientes hasta el cáncer de testículo, Ryan Clark instó a la agencia de medicamentos de su país a tomar la tarea de un telemédico por no revelar adecuadamente los peligros de la finasterida.
Y aunque esperaba una acción más significante, se alienta al paciente de PFS de 54 años del noreste de Inglaterra a marcar la diferencia en el frente de la farmacovigilancia.
Ryan, quien pasó la mayor parte de su carrera empleado por el Gobierno de Su Majestad, se comunicó por primera vez con la Agencia Reguladora de Medicamentos y Productos para el Cuidado de la Salud (MHRA, por sus siglas en inglés) en junio de 2021, con la esperanza de determinar cuánto sabían sobre la condición debilitante y por cuánto tiempo sabían. eso. A través de la Ley de Libertad de Información de 2000, solicitó «todos los correos electrónicos internos con respecto al… ‘Síndrome Post Finasteride’ causado por el fármaco finasteride [desde] 2001 hasta mayo de 2021».
Un mes después, la asesora científica de la MHRA, Alison Banner Simpson, respondió por correo electrónico: “Hemos buscado en nuestros registros y adjuntamos todos los correos electrónicos relevantes”. Pero también señaló: «En línea con otros reguladores en todo el mundo, la MHRA considera que, según los datos actualmente disponibles sobre calidad, seguridad y eficacia, el balance de beneficios y riesgos de la finasterida es positivo».
(Para ver la respuesta completa de la MHRA, que se hizo pública el 29 de diciembre, haga clic aquí).
 Frustrado, Ryan volvió a escribir a la agencia el 29 de septiembre para contarles cómo la finasterida había diezmado su salud, su carrera y su familia. Dos meses después recibió una respuesta de Simpson, leyendo en parte:
Frustrado, Ryan volvió a escribir a la agencia el 29 de septiembre para contarles cómo la finasterida había diezmado su salud, su carrera y su familia. Dos meses después recibió una respuesta de Simpson, leyendo en parte:
Como estoy seguro de que sabe, las etiquetas sobre los efectos secundarios con Propecia son diferentes en los EE. UU. y en Europa, de modo que la disfunción sexual… se sabe que persiste después de la interrupción del tratamiento en algunos pacientes y esto se describe en el producto. información en el Reino Unido y la UE… Además, el estado de ánimo deprimido, la ansiedad, la depresión y, con menor frecuencia, los pensamientos suicidas son efectos secundarios conocidos del tratamiento con finasteride 1 mg…
‘PFS’ no es ampliamente reconocido por la comunidad científica o como un síndrome médicamente reconocido. Como tal, ‘PFS’ no es un efecto secundario conocido del tratamiento con finasterida. Sin embargo, muchos de los síntomas individuales que los pacientes consideran que están asociados con ‘PFS’ se describen en la información del producto… Dada la etiqueta actual, no hay evidencia nueva que justifique más actualizaciones a la información del producto en este momento.
(Para ver la respuesta completa de Simpson, haga clic aquí).
 Nuevamente desalentado porque la MHRA se negó a ordenar advertencias más exhaustivas y extenuantes sobre la finasterida, y mucho menos educar a los médicos y financiar la investigación de PFS, Ryan pensó que se había topado con una pared de ladrillos. Pero menos de un mes después se enteró de que había prestado atención a una de sus quejas: que Sons, una farmacia en línea que se promociona a sí misma como «la salud y el bienestar de los hombres de la próxima generación», pasó por alto por completo el potencial del medicamento para causar daño psicológico y cognitivo en un subconjunto de pacientes.
Nuevamente desalentado porque la MHRA se negó a ordenar advertencias más exhaustivas y extenuantes sobre la finasterida, y mucho menos educar a los médicos y financiar la investigación de PFS, Ryan pensó que se había topado con una pared de ladrillos. Pero menos de un mes después se enteró de que había prestado atención a una de sus quejas: que Sons, una farmacia en línea que se promociona a sí misma como «la salud y el bienestar de los hombres de la próxima generación», pasó por alto por completo el potencial del medicamento para causar daño psicológico y cognitivo en un subconjunto de pacientes.
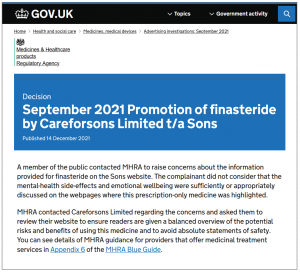
El 14 de diciembre, con base en la evidencia presentada por Ryan, la agencia publicó una decisión titulada Septiembre de 2021 Promoción de finasterida por parte de Careforsons Limited t/a Sons. Decía, en parte:
Un miembro del público se comunicó con la MHRA para plantear inquietudes sobre la información proporcionada sobre la finasterida en el sitio web de Sons. El denunciante no consideró que los efectos secundarios sobre la salud mental y el bienestar emocional se trataran de forma suficiente o adecuada en las páginas web en las que se destacaba este medicamento de venta con receta.
MHRA se comunicó con Careforsons Limited con respecto a las inquietudes y les pidió que revisaran su sitio web para garantizar que los lectores reciban una descripción general equilibrada de los riesgos y beneficios potenciales del uso de este medicamento y para evitar declaraciones absolutas de seguridad.
Entre las declaraciones que hace Sons en su página de preguntas frecuentes sobre Finasteride se encuentran:
«Finasteride es seguro… la mayoría de los hombres toman el medicamento diariamente durante años sin ningún problema».
- «Finasteride es seguro… la mayoría de los hombres toman el medicamento diariamente durante años sin ningún problema».
- «Finasteride no permanece en su sistema por mucho tiempo una vez que deja de tomarlo… De hecho, al suspender el medicamento, generalmente se excreta por completo después de siete días».
- «Para aquellas personas que experimentan efectos secundarios leves, la mejoría generalmente se produce después de un tiempo breve. Sin embargo, si no es así, les sugerimos suspender el medicamento; afortunadamente, los efectos secundarios tienden a ocurrir solo en los primeros seis meses de uso y en el la gran mayoría de las personas deciden suspender la medicación».
 «Me doy cuenta de que este es un pequeño gesto de la MHRA, pero es significativo para mí, como debería ser para todos los pacientes con PFS, porque muestra que una sola voz puede ayudar a responsabilizar a todo un sistema por proteger la salud pública», nos dice Ryan. .
«Me doy cuenta de que este es un pequeño gesto de la MHRA, pero es significativo para mí, como debería ser para todos los pacientes con PFS, porque muestra que una sola voz puede ayudar a responsabilizar a todo un sistema por proteger la salud pública», nos dice Ryan. .
“Animo a cualquiera que crea que no se puede hacer nada con respecto a la epidemia de PFS a que comience a educarse de inmediato sobre los mecanismos que existen en sus propias agencias de medicamentos para sacar a la luz los horrores de PFS”.
Pocos hombres conocen esos horrores mejor que Ryan. Luego, un gerente de operaciones que supervisa a más de 100 empleados en el Servicio Civil, una rama de la división de Ingresos y Aduanas de Su Majestad que implementa políticas nacionales, le recetaron Propecia por primera vez en 1998.
“El único efecto secundario anunciado de Propecia era la posibilidad de una pérdida temporal de la libido que, según se decía, regresaría al dejar el medicamento”, dice Ryan. “Sin embargo, mi experiencia fue muy diferente. En cuestión de semanas, desarrollé ansiedad extrema e insomnio crónico”.
Así que Ryan, que había disfrutado de los mejores niveles de condición física durante toda su vida y no tenía antecedentes de tales condiciones, regresó al médico de cabecera que le recetó, solo para que le dijeran que la causa era el estrés.
Durante los siguientes años, dice que desarrolló una variedad de más de 30 síntomas adicionales que parecen sacados de un cuento de Stephen King, incluidos estos 14 más graves:
- disfunción suprarrenal
- disfunción autonómica
- privación de andrógenos
- tumores benignos
- insomnio crónico
- disfunción congnitiva
- trastornos dermatológicos
- desórdenes gastrointestinales
- trastorno de ansiedad generalizada
- atrofia global de tejidos blandos
- atrofia muscular
- neuropatía
- ideación suicida
- disfunción sexual
(Para acceder a la página de Síntomas informados de PFS de la Fundación PFS, haga clic aquí).
«Lo que encuentro particularmente abrumador es el insomnio crónico y la angustia emocional incesante provocada por los niveles fluctuantes de neuroesteroides», dice Ryan. «Eso es lo que hace que muchos pacientes con PFS se quiten la vida».
 En total, Ryan pasó 15 años sin ningún indicio de que la finasterida pudiera ser la causa de su sufrimiento. Peor es que, entre la multitud de médicos que lo trataron, ninguno preguntó sobre su uso de finasteride, a pesar de que les dijo a todos que estaba tomando la droga.
En total, Ryan pasó 15 años sin ningún indicio de que la finasterida pudiera ser la causa de su sufrimiento. Peor es que, entre la multitud de médicos que lo trataron, ninguno preguntó sobre su uso de finasteride, a pesar de que les dijo a todos que estaba tomando la droga.
Durante su propia búsqueda de lo que le aquejaba, Ryan se enteró del Yellow Card Scheme, el sistema de la MHRA para “recolectar y monitorear información sobre problemas de seguridad, como sospechas de efectos secundarios o incidentes adversos relacionados con medicamentos y dispositivos médicos”.
“Es extremadamente preocupante que ningún médico me sugirió que presentará una tarjeta amarilla por finasterida, o que presentará una en mi nombre”, dice.
Solo después de tropezar con el sitio web de la Fundación PFS en 2015, tiró su Propecia por el inodoro y nunca miró hacia atrás. Un año después, un endocrinólogo le diagnosticó oficialmente PFS.
Aún así, la vida de Ryan no mejoró. De hecho, las cosas han empeorado progresivamente. PFS ha cobrado un precio enorme en su matrimonio y sus relaciones personales. Él y su esposa Lyndsey tienen un hijo de nueve años, y esa familia es la razón principal por la que sigue luchando.
«Tengo mucho por lo que vivir, pero mis síntomas implacables hacen que cada día sea insoportable», dice. «Y el hecho de que prácticamente todos los médicos que he visto no tienen idea de lo que está pasando hace que mi situación empeore aún más. Si las cosas no cambian pronto, se perderán más vidas».
Debido al deterioro de su salud física y función cognitiva, Ryan finalmente dejó su trabajo en 2019. «Según mi evaluación médica más reciente, es poco probable que pueda volver a trabajar», dice.
“Aparentemente, soy único en el sentido de que soy uno de los pocos desafortunados que empeora, y todavía está vivo, después de tomar este Frankenstein de una droga. A medida que la situación continúa empeorando, me aterra pensar en dónde terminará.
«No hay terapias conocidas para la PFS disponibles, sin embargo, hombres jóvenes previamente sanos en todo el mundo mueren cada mes a causa de esta afección. Personalmente, conozco a algunos que están postrados en cama y ya ni siquiera pueden tragar alimentos.
«¿Todo este sufrimiento y carnicería solo por una droga cosmética?» Ryan concluye. «Las autoridades de salud pública deben eliminarlo inmediatamente del mercado».
Si desea obtener más información sobre cómo navegar por los canales de farmacovigilancia y/o ayudar con sus esfuerzos, no dude en comunicarse con Ryan en clarkpod1@hotmail.co.uk.
 If you’d like to learn more about navigating pharmacovigilance channels and/or help with his efforts, feel free to contact Ryan at clarkpod1@hotmail.co.uk.
If you’d like to learn more about navigating pharmacovigilance channels and/or help with his efforts, feel free to contact Ryan at clarkpod1@hotmail.co.uk.
Cualquier persona que viva en los EE. UU. Que sufra de PFS debe informar sus síntomas a la Administración de Alimentos y Medicamentos de EE. UU. Cualquier persona que viva fuera de los EE. UU. Que padezca PFS debe informar sus síntomas a la Administración de Alimentos y Medicamentos de EE. UU. Y a su agencia nacional reguladora de medicamentos, como se indica en nuestra página Informe sus efectos secundarios.
Por último, si usted o un ser querido padece PFS y se siente deprimido o inestable, no dude en ponerse en contacto con la Fundación PFS lo antes posible a través de nuestra línea directa de atención al paciente: social@pfsfoundation.org
Gracias.
Noticias Relacionadas
