इसी बीच यूएस डिस्ट्रिक्ट कोर्ट ने सारे सील बंद दस्तावेजों को खोलने का आदेश दिया
फरवरी 1, 2021
प्यारे मित्रों:
 पीएफएस फाउंडेशन ने एफडीए सिटीजन पिटिशन को सप्लीमेंट पेश करते हुए यह निवेदन किया कि एजेंसी “तुरंत प्रोपेशिया की बिक्री की अनुमति को रद्द करें, क्योंकि दवा के नुकसान इसके फायदे से बहुत ज्यादा है“
पीएफएस फाउंडेशन ने एफडीए सिटीजन पिटिशन को सप्लीमेंट पेश करते हुए यह निवेदन किया कि एजेंसी “तुरंत प्रोपेशिया की बिक्री की अनुमति को रद्द करें, क्योंकि दवा के नुकसान इसके फायदे से बहुत ज्यादा है“
यह दो सप्लीमेंट, दिसंबर 1,2020 को दर्ज किए गए और पिछले महीने के आखिर में सार्वजनिक किए गए, रेगुलेशन.जीओवी पर, एक यूएस फेडरल वेबसाइट, जो दस्तावेज संग्रह करती है और नागरिकों को सरकारी एजेंसियों के साथ मिलकर नियम बनाने में मदद करती है ।
याचिका सप्लीमेंट 1 में वैज्ञानिक शोध, एपिडेमियोलॉजिकल डाटा और अन्य जरूरी तथ्य सार्वजनिक किए गए, जो हमारे नागरिक याचिका 19 सितंबर, 2017 को दायर किए जाने के बाद प्रकाशित किए गये ।
(ए) जानवरों पर हुए अनुसंधान:
- नर चूहों के इलाज में फिनेस्ट्रिड, एक 5अल्फा–रेडक्टेज़ काअवरोधकएंजाइम, से दीर्घकालीन प्रभाव पाये गए जिनमें, अवसाद जैसे लक्षण , हिप्पोकैम्पस न्यूरोजेनेसिस (नसों का बनना और बढ़ना ), न्यूरोइन्फ्लेमेशन( नाड़ियों में सूजन ) और अँतड़ियो की सूक्ष्म जीवी सँरचना में बदलाव थे
- स्टेरिओजेनिसिस अवरोधक फाइनस्टराइड तनावपूर्ण और लाभप्रद,दोनों तरह की उत्तेजना में प्रतिक्रिया को कम कर देता है
(बी) क्लिनिकी अनुसंधान:
- पोस्ट–फाइनस्टराइड रोगियों के स्पाइनल द्रव SRD5A जीन के अंदर मेथीलेशन पैटर्न में बदलाव :एक प्रारंभिक अध्ययन
- पुरुषों में एंड्रोजेनिक एलोपेसिया के इलाज के लिए फाइनस्टराइड के प्रयोग के बाद दीर्घस्थायी दुष्प्रभाव से शिश्न संवहनी में असमानताएं पायी गयी
- फाइनस्टराइड और आत्महत्या : एक पोस्ट–विपणन श्रृंखला
- फाइनस्टराइड से उपचारित मरीज़ो में आत्मघाती और मानसिक दुष्प्रभावी वृत्तांतों का विवेचन
(सी) अमेरिका से बाहर की ड्रग नियंत्रक एजेंसियां । फाउंडेशन लिखता है:
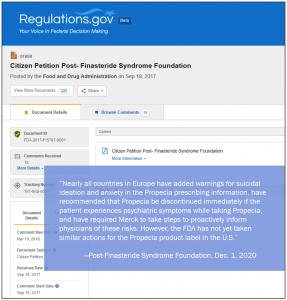
यूरोप में लगभग सभी देशों ने प्रॉपेशिया निर्धारित जानकारी में आत्मघाती विचारों और घबराहट के लिए अतिरिक्त चेतावनी दी है और सुझाव दिया है की मरीज़ को कोई भी मानसिक लक्षण महसूस होने पर प्रोपेशिया को तुरंत बंद कर दिया जाये और मर्क को निर्देश दिए हैं की अग्रसक्रिय होकर चिकित्सको को इन दुशप्रभावों की जानकारी दी जाये। हालाँकि, एफडीए ने प्रोपेशिया उत्पाद लेबल में यूनाइटेड स्टेट्स में कोई ऐसी कोई कार्यवाही नहीं की है :
- हेल्थ – कनाडा: प्रोपेशिया और परोस्कर पर सुरक्षा समीक्षा सारांश
- मेडिसिन एंड हेल्थ केयर प्रोडक्ट्स रेगुलेटरी एजेंसी (यूके): प्रोपेशिया प्रोडक्ट संलक्षणों का सारांश
- यूरोपियन मेडिसिन एजेंसी: सीएमडीएच की दुश्चिंता पर प्रक्रिया प्रोपेशिया प्रोडक्ट संलक्षणों का सारांश, इ ऍम ए
- फ़ेडरेशन इंस्टीट्यूट फॉर ड्रग्स एंड मेडिकल डिवाइसेस (BfArM जर्मनी): फ़िनस्टराइड रेड हैंड लेटर
- दवाओं और स्वास्थ्य उत्पादों की सुरक्षा के लिए राष्ट्रीय एजेंसी (ए एन एस एम फ्रांस)
याचिका सप्लीमेंट 2 में विशेष रूप से रायटर्स की रिपोर्ट को प्रस्तुत किया कि “कोर्ट ने मर्क को लोकप्रिय दवाई के दुष्प्रभावों के राज़ को छुपाने दिया”
11 सितंबर, 2019 को प्रकाशित एक वर्ष लंबी जांच पड़ताल के उपरांत डेन लवीन द्वारा लिखा लेख मर्क के पूर्व कार्य पालक की ‘संयुक्त राज्य प्रपेशिया मुकदमे’ में दी गई गवाही को उजागर करता है, कि दवा दिग्गज द्वारा क्लीनिकल परीक्षणों में दवा के दुष्प्रभाव की अनदेखी की गई है। क्लीनिकल परीक्षणों में पाए गए ‘फिनास्टेराइड’ के जड़ दुष्प्रभावों को चेतावनी पर्चे पर भी प्रकट करने में मर्क असमर्थ रहे।
इस पारदर्शिता की कमी के बावज़ूद मुकदमे के न्यायाधीश ब्रायन कोगन ने मर्क और प्लेंटिफ्स के वकीलों को अदालत में प्रस्तुत की गई जानकारी को गोपनीय रखने की अनुमति दी। जैसे लवीन, जिसकी रिपोर्ट ने हमारी नागरिक याचिका को भी उजागर किया, व्याख्यान करते हैं:
इनमें से कुछ दस्तावेज गोपनीयता की दीवार के पीछे अज्ञात रहे। इनमें से एक दस्तावेज अनजाने में सार्वजनिक जानकारी में आया तथा जब्त होने से पहले एक वर्ष तक सार्वजनिक रहा। इसी बीच इन दस्तावेजों ने अस्पष्ट पब्लिक फाइलिंग में जगह बनाई,जहां पर रॉयटर्स (Reuters) ने इन्हें पाया। अन्य दस्तावेज गलती से दोबारा संपादित हुआ ,जिस कारण रिपोर्टर के लिए यह पढ़ना संभव हुआ।
 इन दस्तावेजों में शारलेट मेरिट, जो प्रपेशिया की विनियामक गतिविधियों को देखती थी तथा पॉल होबस जोकि प्रेस्क्राइब दवाओं के मार्केटिंग का नेतृत्व करते थे,इन दोनों के बयान शामिल थे।
इन दस्तावेजों में शारलेट मेरिट, जो प्रपेशिया की विनियामक गतिविधियों को देखती थी तथा पॉल होबस जोकि प्रेस्क्राइब दवाओं के मार्केटिंग का नेतृत्व करते थे,इन दोनों के बयान शामिल थे।
शारलेट मेरिट ने यह स्वीकार किया कि वर्ष 2002 में प्रपेशिया के बाजार में आने के 4 वर्ष पश्चात मर्क ने दवा लेबल पर यौन प्रतिकूलता घटनाओं को लेकर बदलाव किए जोकि “सभी पुरुषों में आई सूजन में कमी जिन्होंने प्रपेशिया का उपयोग बंद किया” से ”पुरुषों में आई सूजन में कमी जिन्होंने प्रपेशिया का उपयोग बंद किया” । इसके पश्चात् उसने गवाही दी कि मर्क ने शब्द “सभी” को इसलिए हटाया क्योंकि क्लिनिकल परीक्षणों ने इस बात को स्पष्ट नहीं किया की दवा बंद करने के पश्चात् मरीज पर क्या दुष्प्रभाव थे।
होवस ने यह स्वीकार किया कि मर्क को इस बात का ज्ञान था कि यौनदुष्प्रभावों की चेतावनीयां,मुख्य रूप से स्थाई रूप के जड़ दुष्प्रभावों की चेतावनीयां प्रपेशिया की बिक्री के लिए मौत की घंटी साबित होगी।
लवीन के लेख निकलने के एक दिन पश्चात रॉयटर्स ने यूएस.फेडरल कोर्ट में प्रस्ताव दर्ज किया कि सभी प्रपेशिया मुकदमे संबंधित दस्तावेजों को सार्वजनिक किया जाए। पश्चिमी दुनिया की सबसे बड़ी समाचार संस्था ने यह तर्क दिया “यह मामला अत्याधिक महत्वपूर्ण है कि किस तरह एक मामले को सीलबंद किया, जबकि इस सीलबंद का आधिकारिक रूप से कोई भी स्पष्टीकरण नहीं दिया गया। पहला संशोधन इस तरह के परिणाम पर रोक लगाता है।“
याचिका सप्लीमेंट 2 में विशेष रूप से रायटर्स की रिपोर्ट को प्रस्तुत किया कि “कोर्ट ने मर्क को लोकप्रिय दवाई के दुष्प्रभावों के राज़ को छुपाने दिया”
25 जनवरी को 16 महीने बाद संयुक्त राज्य न्यायाधीश पेगी कू ने रॉयटर्स के प्रस्ताव को मंजूरी दी जिसने प्रपेशिया मुकदमे के सभी मर्क दस्तावेजों का सर्वजन में आने का रास्ता खोला।
उनके फैसले में, कू ने बयान दिया कि दस्तावेजों को सीलबंद रखने के लिए मर्क के तर्क इतने कमजोर हैं, कि वे आम कानूनों के अंतर्गत सार्वजनिक पहुंच(presumption of access) को दूर नहीं रख पाते।
 अमेरिका में रहने वाला कोई भी व्यक्ति जो पीएफएस से पीड़ित है, उसे अपने लक्षण अमेरिकी खाद्य एवं औषधि प्रशासन को रिपोर्ट करने चाहिए। यूएस के बाहर रहने वाला कोई भी व्यक्ति जो पीएफएस से पीड़ित है, उसे अपने लक्षण फूड एंड ड्रग एडमिनिस्ट्रेशन और अपनी राष्ट्रीय दवा-नियामक एजेंसी, को रिपोर्ट करने चाहिए, जैसा कि हमारी वेबसाइट के पेज रिपोर्ट योर साइड इफेक्ट्स पर निर्देशित है।
अमेरिका में रहने वाला कोई भी व्यक्ति जो पीएफएस से पीड़ित है, उसे अपने लक्षण अमेरिकी खाद्य एवं औषधि प्रशासन को रिपोर्ट करने चाहिए। यूएस के बाहर रहने वाला कोई भी व्यक्ति जो पीएफएस से पीड़ित है, उसे अपने लक्षण फूड एंड ड्रग एडमिनिस्ट्रेशन और अपनी राष्ट्रीय दवा-नियामक एजेंसी, को रिपोर्ट करने चाहिए, जैसा कि हमारी वेबसाइट के पेज रिपोर्ट योर साइड इफेक्ट्स पर निर्देशित है।
अंत में, यदि आप या आपका कोई प्रियजन पीएफएस से पीड़ित हैं, और उदास या अस्थिर महसूस कर रहा हैं, तो कृपया हमारे रोगी सहायता हॉटलाइन के माध्यम बिना किसी संकोच के जल्दी से जल्दी पीएफएस फाउंडेशन से संपर्क करें,
रोगी सहायता हॉटलाइन : social@pfsfoundation.org
धन्यवाद !
सम्बंधित खबर
Regulatory Update: France’s FDA-Equivalent Agency Reissues Finasteride Warning (Feb. 2, 2019)
Regulatory Update: MHRA Issues Drug Safety Update on Finasteride (May 26, 2017)
