23 de junio de 2022
Queridos amigos:
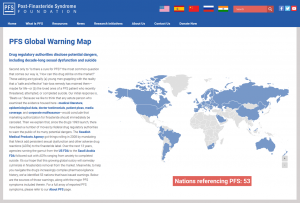 La Fundación PFS ha lanzado un mapa interactivo que traza todas las naciones que han emitido advertencias sobre el potencial de la finasterida para causar reacciones adversas persistentes, también conocido como síndrome post-finasterida (SPF).
La Fundación PFS ha lanzado un mapa interactivo que traza todas las naciones que han emitido advertencias sobre el potencial de la finasterida para causar reacciones adversas persistentes, también conocido como síndrome post-finasterida (SPF).
Cincuenta y tres países, desde Argentina hasta los Estados Unidos, componen nuestro Mapa de Alerta Global SPF. Cada uno aparece en la entrada de la tabla que, a su vez, se vincula a al menos un documento original de la autoridad reguladora de medicamentos (DRA) de la nación respectiva.
Además, se proporcionan traducciones al inglés para todos los textos que no están en inglés.
Sobre todo, el mapa demuestra un consenso más amplio de los síntomas de PFS que cualquier DRA individual. De manera similar, brinda información sobre cómo las DRA más vigilantes (a) determinan las asociaciones causales entre la finasterida y los informes de casos de reacciones adversas, (b) alertan a los profesionales de la salud cuando surgen nuevas investigaciones clínicas y datos epidemiológicos, y (c) elaboran una política regulatoria basada en los peligros potenciales de la terapia con finasteride. Por ejemplo:
- Canadá: en 2018, Health Canada ordenó que los trastornos relacionados con los músculos se agregaran a la literatura local de los productos Propecia (finasteride 1 mg) y Proscar (finasteride 5 mg). Un año después, la agencia «concluyó que puede haber una relacion entre Proscar y Propecia… y el riesgo de ideación suicida».
- China: En 2019, dos meses después de que Canadá emitiera su advertencia de ideación suicida, la Administración Nacional de Productos Médicos emitió una Advertencia de seguridad de medicamentos, que señalaba: “Entre 2012 y 2016, la tasa informada de incidentes de suicidio/autoagresión relacionados con la finasterida en Canadá aumentó 2,5 veces… Actualmente, la Administración de Drogas y Alimentos de los Estados Unidos (FDA) no ha requerido cambios en el etiquetado de Proscar o Propecia”.
- Bélgica: En 2017, la Agencia Federal de Medicamentos y Productos Sanitarios (FAMHP) publicó un informe de última hora que señala: “Los nuevos datos, analizados por la Agencia Europea de Medicamentos (EMA), han concluido que los riesgos de trastornos del estado de ánimo, ideación suicida y la depresión es posible si se toma finasteride a 1 mg/día… Es importante que los pacientes estén informados de estos riesgos, ya que no hay ningún prospecto que acompañe las prescripciones personalizadas [es decir, aquellas preparadas por farmacéuticos según las especificaciones del médico] de finasteride a 1 mg.
- Brasil: En 2019, el fabricante de finasterida Merck SA, en acuerdo con la Agencia Nacional de Vigilancia Sanitaria (ANVISA), emitió una Carta a los Profesionales de la Salud informándoles que «según los informes de casos sobre pacientes individuales, la disfunción sexual puede… persistir durante más de 10 años después de interrupción del tratamiento.” Diecisiete años antes, después de evaluar el uso de la finasterida en cosméticos, ANVISA publicó una opinión técnica que señaló: “[F]inasterida, cuando se aplica tópicamente, tiene absorción sistémica, por lo que produce los mismos efectos secundarios que cuando se usa por vía oral. [El Comité Técnico Asesor de Cosméticos] recomienda: Prohibir el uso de finasteride en productos cosméticos.”
- Australia: En 2019, la Administración de Productos Terapéuticos (TGA) publicó una decisión provisional en relación con la finasterida, señalando: “[E]aquí existe la posibilidad de que el uso de la finasterida pueda resultar en un Síndrome Post Finasterida… [D]own-scheduling finasteride to El Anexo 3 sentaría un precedente peligroso para los medicamentos de la Categoría X, y los riesgos potenciales de un acceso más amplio bajo el Anexo 3 superan significativamente los beneficios”.
- Francia: en 2019, la Agencia para la Seguridad de Medicamentos y Productos Sanitarios (ANSM) “publicó una hoja informativa para hombres que actualmente toman finasterida para tratar la caída del cabello, o para quienes se está considerando la prescripción, [que fue] desarrollada en junto con asociaciones de pacientes y profesionales de la salud interesados [y] tiene como objetivo reforzar la información del paciente sobre el riesgo de ciertos efectos adversos, como trastornos psiquiátricos y/o disfunción sexual”.
- Nueva Zelanda: En 2016, la Autoridad de Seguridad de Medicamentos y Dispositivos Médicos (Medsafe) publicó una Actualización para prescriptores en la que se señala que «el Síndrome posterior a la finasterida… se agregó recientemente a la lista de enfermedades raras y genéticas de los Institutos Nacionales de Salud (NIH) de EE. UU.» También publicó la lista completa de síntomas de PFS informados de What Is PFS? de la Fundación PFS. página, que van desde la ansiedad hasta el tinnitus.
- Arabia Saudita: en 2021, la Autoridad de Alimentos y Medicamentos de Arabia Saudita (SFDA) publicó una Señal de seguridad que concluyó: “La evidencia acumulada ponderada identificada a partir de los casos informados, la literatura y la extracción de datos son suficientes para respaldar una asociación causal entre Finasteride y el riesgo de Diabetes Mellitus”. En 2018, Merck Arabia Saudita, de acuerdo con la SFDA, distribuyó una comunicación directa para profesionales de la salud que señalaba que: “Los pacientes deben ser conscientes del riesgo de experimentar… disfunción sexual… durante la terapia con finasterida. También se debe informar a los pacientes que se han recibido informes de casos de disfunción sexual… que persistieron después de la interrupción de la terapia… Los profesionales de la salud deben monitorear cuidadosamente a los pacientes durante el tratamiento con finasterida para detectar síntomas psiquiátricos (que incluyen ansiedad, depresión e ideación suicida)».
- Estados Unidos: En 2000, en respuesta a la Petición Ciudadana de Merck para aprobar finasterida para uso pediátrico, la Administración de Drogas y Alimentos (FDA) escribió: “A la FDA le preocupa que el uso de finasterida por parte de pacientes pediátricos pueda presentar riesgos de seguridad a largo plazo con respecto al crecimiento, desarrollo y función sexual. Por supuesto, cualquier uso propuesto en la población pediátrica debería tener en cuenta estos problemas de seguridad. En consecuencia, su petición es denegada”.
En el futuro, planeamos actualizar el mapa (que se encuentra en el menú Recursos en nuestra barra de navegación) con nuevas advertencias, pautas y/o acciones de DRA sobre la finasterida tan pronto como estén disponibles. Para ayudar en este esfuerzo, invitamos a las partes interesadas que viven en países que actualmente no están representados en el mapa a comunicarse con sus DRA locales y solicitar copias electrónicas de la literatura y/o noticias más recientes sobre el producto de finasterida. Todo ese contenido debe enviarse por correo electrónico a Philip Roberts.
 Cualquier persona que viva en los EE. UU. que sufra de PFS debe informar sus síntomas a la FDA de los EE. UU. Cualquier persona que viva fuera de los EE. UU. y sufra de PFS debe informar sus síntomas a la FDA de los EE. UU., así como a su DRA local, como se indica en nuestra página Informe sus efectos secundarios.
Cualquier persona que viva en los EE. UU. que sufra de PFS debe informar sus síntomas a la FDA de los EE. UU. Cualquier persona que viva fuera de los EE. UU. y sufra de PFS debe informar sus síntomas a la FDA de los EE. UU., así como a su DRA local, como se indica en nuestra página Informe sus efectos secundarios.
Finalmente, si usted o un ser querido sufre de PFS y se siente deprimido o inestable, no dude en comunicarse con la Fundación PFS lo antes posible a través de nuestra línea directa de atención al paciente: social@pfsfoundation.org
Gracias.
Noticias Relacionadas
