2019年12月20日
亲爱的朋友们:
法国食品药品监督管理局(FDA)等效机构上周发布了一份信息要点和情况说明书,内容是针对目前正在服用非那雄胺治疗脱发或正在考虑服用该药治疗脱发的男性。
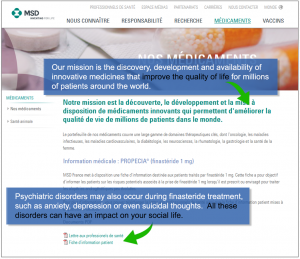 “本简介是与相关患者协会和卫生专业人员共同开发的,旨在加强患者信息,了解与使用非那雄胺有关的某些不良反应(例如精神疾病和/或性功能障碍)的风险,”国家安全局说duMédicamentet des Produits deSanté(ANSM)(此处为英文翻译)。
“本简介是与相关患者协会和卫生专业人员共同开发的,旨在加强患者信息,了解与使用非那雄胺有关的某些不良反应(例如精神疾病和/或性功能障碍)的风险,”国家安全局说duMédicamentet des Produits deSanté(ANSM)(此处为英文翻译)。
该机构补充说:“目前正在欧洲和国家层面对非那雄胺1 mg的使用进行严格监控。” “重要的是,必须广泛共享有关其安全性的信息。为此,ANSM于2019年10月与患者代表和卫生专业人员会面,以制定一份信息文件,以补充1毫克非那雄胺包装盒中的传单。”
在2019年11月的一封信中(英文翻译),ANSM要求非那雄胺生产商默克公司的子公司MSD France将该情况说明书(英文翻译)发送给皮肤科医生,全科医生和药剂师,以期首次开具Propecia处方时,应由医生给予患者;在配药时,应由药剂师给予患者。
其消息包括:
- 性疾病:“患者已报告性疾病,包括勃起功能障碍,射精功能障碍,睾丸疼痛和性欲降低。在无限期停止治疗后,这些效果可能会持续存在。”
- 精神疾病:“非那雄胺治疗期间也可能发生精神疾病,例如焦虑,抑郁甚至自杀念头。所有这些疾病都会影响您的社交生活。”
- 不良反应能持续多久? “在非那雄胺治疗期间发生不良事件所需的时间可能有所不同,从开始治疗后的几天到几年。不良反应的持续时间也可能因患者而异。停止治疗后可能还会持续出现不良反应,在某些情况下还会持续不确定的时间。”
 这是最新的信息点和情况说明书,标志着ANSM两年来第三次发布公共信息警告,警告可能对该药物产生不良反应。
这是最新的信息点和情况说明书,标志着ANSM两年来第三次发布公共信息警告,警告可能对该药物产生不良反应。
居住在美国的任何患有PFS的人都应向美国食品和药物管理局报告其症状。居住在美国境外的所有患有PFS的人都应按照我们的“报告您的副作用”页面的指示,向美国食品和药物管理局以及其国家药品监管机构报告其症状。
最后,如果您或您所爱的人患有PFS并感到沮丧或不稳定,请立即通过我们的患者支持热线:social@pfsfoundation.org与PFS基金会联系。
谢谢。
相关新闻
Regulatory Update: France’s FDA-Equivalent Agency Reissues Finasteride Warning
Regulatory Update: Germany’s FDA Equivalent Issues ‘Red Hand Letter’ on Finasteride ADRs
Regulatory Update: MHRA Issues Drug Safety Update on Finasteride
